CLASIFICACIÓN DE LA MATERIA Y MÉTODOS DE SEPARACIÓN
¿Qué es la materia?
La materia es todo aquello que tiene masa y ocupa un lugar en el espacio.
Es decir, todo lo que puedes ver, tocar o sentir está hecho de materia.
Por ejemplo: una mesa, el aire, el agua, una planta o una piedra.
Incluso las cosas que no se ven, como el oxígeno o el gas natural, son materia porque tienen masa y volumen.
La materia puede presentarse en diferentes estados físicos, como sólido, líquido, gas o plasma, y está formada por pequeñas partículas llamadas átomos.
Cómo se clasifica la materia
Toda la materia del universo se puede clasificar en dos grandes grupos:
-
Sustancias puras
-
Mezclas
Esta clasificación depende de si la composición de la materia es fija o variable.
Sustancias puras
Una sustancia pura es aquella que tiene una composición constante y propiedades definidas.
Esto significa que siempre contiene los mismos componentes en la misma proporción, sin importar de dónde provenga.
Por ejemplo, el agua pura siempre está formada por moléculas con dos átomos de hidrógeno y uno de oxígeno (H₂O).
No importa si el agua viene de un río, un lago o una botella, químicamente es la misma sustancia.
Las sustancias puras no pueden separarse por métodos físicos (como filtrar o decantar), solo mediante métodos químicos que rompan los enlaces entre sus átomos.
Las sustancias puras se dividen en elementos y compuestos.
🔹 Elementos
Un elemento es una sustancia formada por átomos del mismo tipo.
No se puede descomponer en sustancias más simples mediante procesos químicos comunes.
Existen más de 100 elementos conocidos, los cuales se representan con símbolos químicos en la tabla periódica, como H (hidrógeno), O (oxígeno), Fe (hierro), Na (sodio) o C (carbono).
Ejemplos:
-
El oxígeno del aire (O₂)
-
El oro (Au)
-
El hierro (Fe)
🔹 Compuestos
Un compuesto está formado por átomos de dos o más elementos distintos unidos químicamente en proporciones fijas.
Esto significa que sus componentes no se pueden separar fácilmente sin romper los enlaces químicos.
Por ejemplo:
-
El agua (H₂O) está formada por hidrógeno y oxígeno.
-
El cloruro de sodio (NaCl), o sal común, está hecho de sodio y cloro.
-
El dióxido de carbono (CO₂) está formado por carbono y oxígeno.
Un compuesto tiene propiedades totalmente diferentes a las de los elementos que lo forman.
Por ejemplo, el sodio es un metal explosivo y el cloro es un gas tóxico, pero al unirse forman la sal de mesa, que es comestible.
Mezclas
Una mezcla se forma cuando dos o más sustancias se combinan sin reaccionar químicamente, es decir, sin formar nuevas sustancias.
Cada componente conserva sus propiedades originales, y normalmente puede separarse por medios físicos.
Por ejemplo, si mezclas agua y arena, obtienes una mezcla en la que tanto el agua como la arena mantienen sus propiedades.
Las mezclas pueden clasificarse en homogéneas y heterogéneas:
🔹 Mezclas homogéneas
Son aquellas en las que los componentes no se distinguen a simple vista y tienen una sola fase visible.
También se les llama soluciones.
Ejemplos:
-
El aire (mezcla de gases como nitrógeno, oxígeno y dióxido de carbono)
-
El agua con sal disuelta
-
El alcohol con agua
En una mezcla homogénea, las sustancias se encuentran distribuidas uniformemente, y aunque parecen una sola cosa, en realidad son varias mezcladas.
🔹 Mezclas heterogéneas
En este tipo de mezcla, los componentes sí se pueden distinguir a simple vista o al microscopio.
Tienen dos o más fases visibles y los componentes no están distribuidos uniformemente.
Ejemplos:
-
Agua con aceite (se separan en dos capas)
-
Ensalada (puedes ver los ingredientes)
-
Arena con agua
En este caso, cada componente se puede separar con facilidad usando métodos físicos simples.
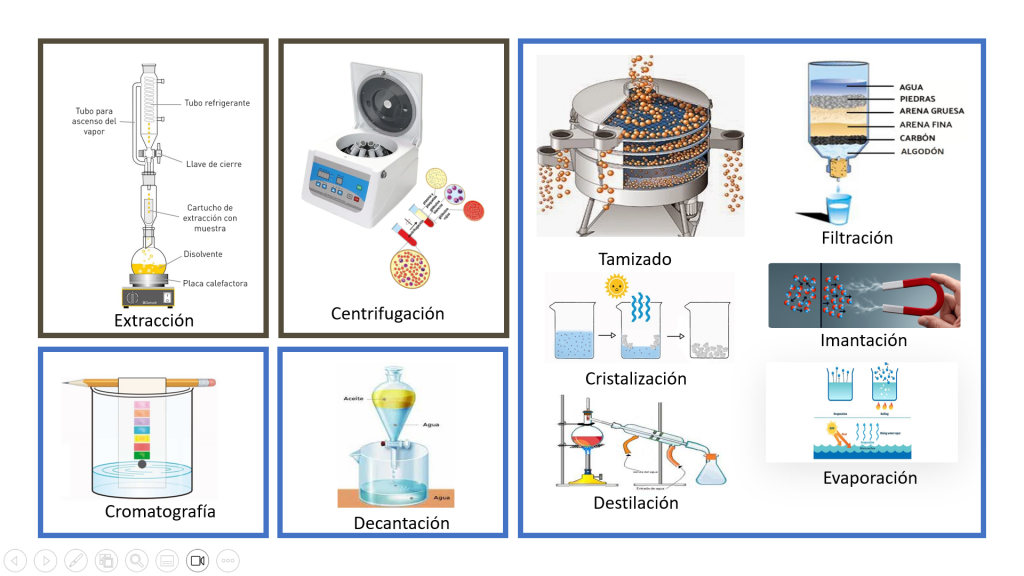
Métodos de separación de heterogéneas
Como las mezclas no tienen una unión química, sus componentes pueden separarse sin alterar su composición, aprovechando diferencias en propiedades físicas como el tamaño de partícula, densidad, punto de ebullición o magnetismo.
A continuación, se explican los métodos más importantes:
- Decantación
Separar líquidos inmiscibles o un sólido de un líquido por diferencia de densidades. Ejemplo: Separar agua de aceite.
- Filtración
Separar sólidos de líquidos usando un filtro que retenga las partículas.
Ejemplos:
- Colar café
- Filtro para reutilizar el agua gris del hogar
3. Tamizado
Separa sólidos de diferente tamaño de partícula usando una malla.
- Ejemplo: separar harina de grumos o piedras de arena.
4. Imantación
Se basa en la atracción que ejercen los imanes sobre materiales con propiedades magnéticas, como el hierro, el níquel o el cobalto.
Ejemplos
- Separar limaduras de hierro mezcladas con arena.
- En la industria, se usa para separar metales ferrosos de materiales no metálicos en el reciclaje.
- Separar clavos de madera o plástico en un taller.
5. Centrifugación
Se basa en la diferente densidad de los componentes. Consiste en hacer girar la mezcla a gran velocidad en un aparato llamado centrífuga.
Los componentes más densos se van al fondo (sedimento).
Los menos densos quedan en la parte superior (sobrenadante o sobrenadante líquido).
A continuación se muestran cada uno de los esquemas representativos de los métodos de separación de mezclas homogéneas y heterogéneas
Actividad
Toma materiales caseros y realiza ejemplos:
-
Filtración: mezcla agua con arena y sepárala con un filtro de café.
-
Decantación: mezcla agua y aceite, observa cómo se separan las capas.
-
Evaporación: deja un vaso con agua salada al sol y observa cómo queda la sal.
-
Imantación: mezcla limaduras de hierro con azúcar y usa un imán para separarlas.
Esto te ayudará a observar los métodos de separación en acción y comprender cómo funcionan.