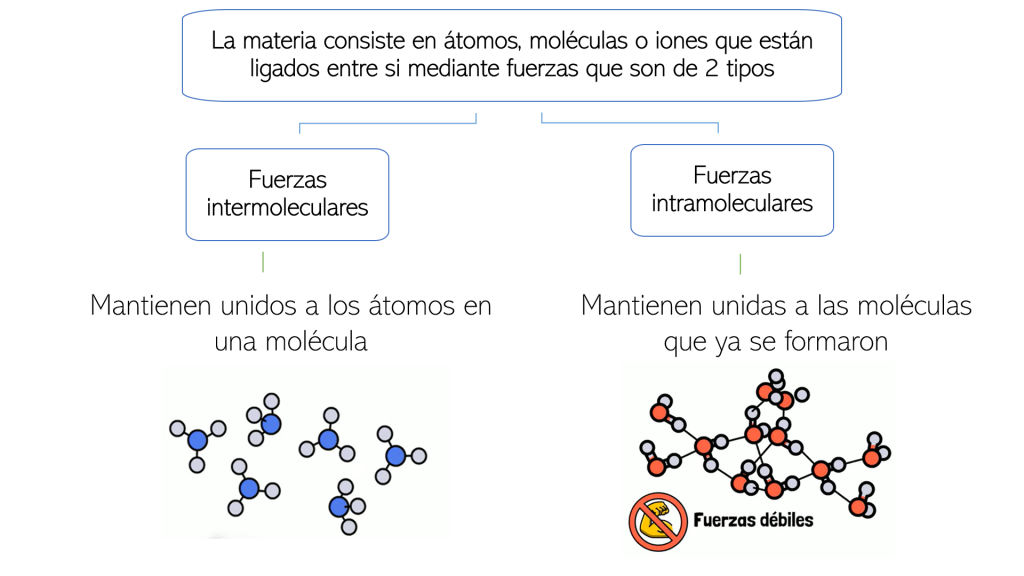
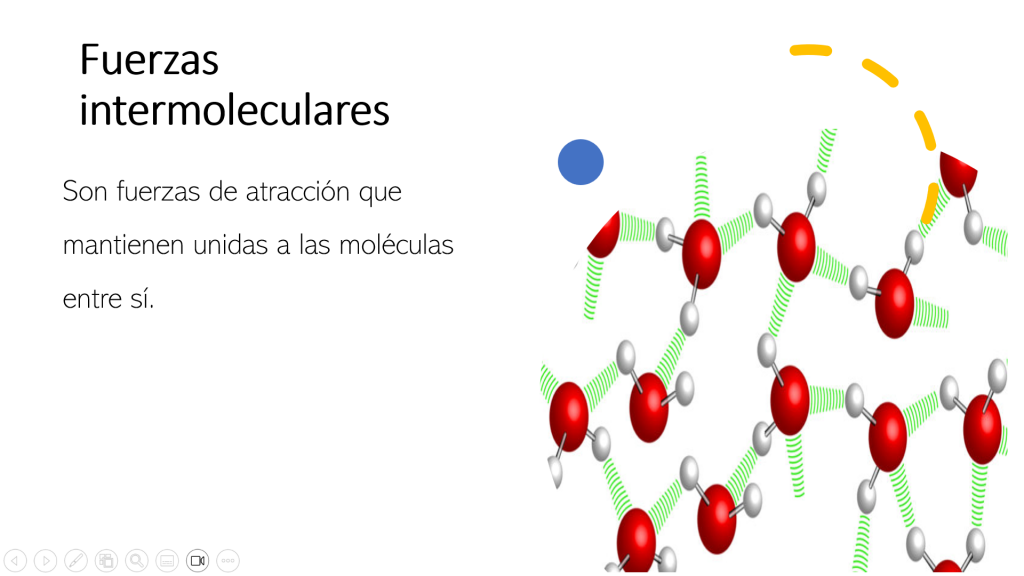
Fuerzas intermoleculares
Importancia de las fuerzas intermoleculares
|
Propiedad |
Explicación |
|
Punto de ebullición y fusión |
Cuanto más fuertes son las fuerzas, más difícil es romperlas, por eso el punto de ebullición es mayor. (que tan fácil o difícil es que hierva a que temperatura se derrite) |
|
Estado físico |
Sustancias con fuerzas débiles → gases. Sustancias con fuerzas fuertes → líquidos o sólidos. |
|
Solubilidad |
Las sustancias polares se disuelven en disolventes polares (como el agua). “Lo semejante disuelve a lo semejante”. |
|
Tensión superficial |
El agua tiene alta tensión superficial por sus puentes de hidrógeno. |
Características importantes
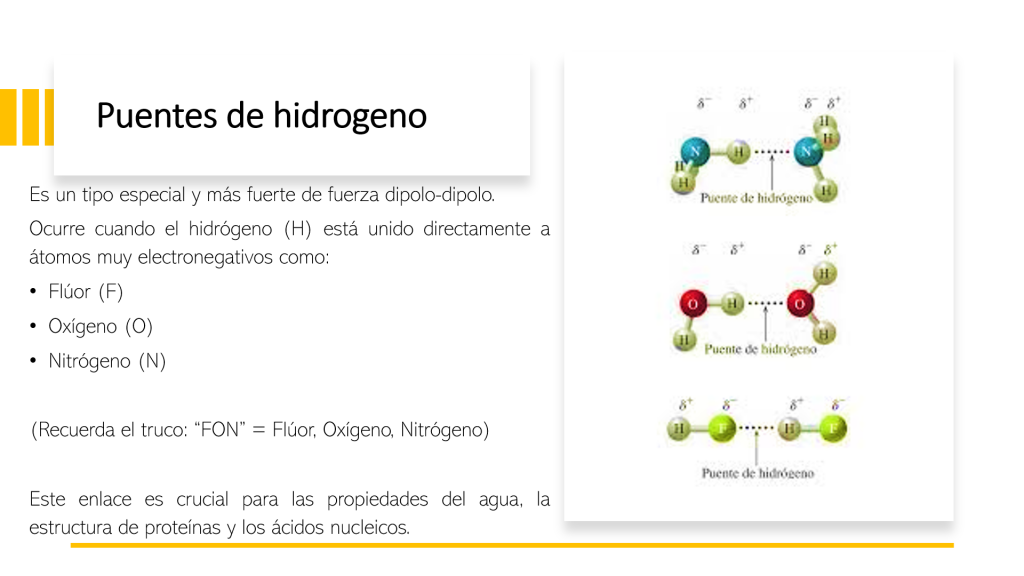
Fuerza variable: La fuerza del puente de hidrógeno depende de la diferencia de electronegatividad.
Los puentes entre hidrógeno y flúor H-F son más fuertes que los de hidrógeno y oxígeno H-O o hidrógeno y nitrógeno H-N.


Aplicaciones
Determinación de propiedades físicas: Estas fuerzas explican por qué el agua a temperatura ambiente es líquida, mientras que moléculas más pequeñas como el metano son gases. Unas fuerzas intermoleculares más fuertes implican mayores puntos de fusión y ebullición porque se necesita más energía para separarlas.
Comportamiento de la materia: Son responsables de la condensación de los gases a líquidos.
Procesos biológicos: Desempeñan un papel en la estructura de moléculas biológicas, como la doble hélice del ADN, que está estabilizada por puentes de hidrógeno entre las bases nitrogenadas.
Intensidad de las fuerzas
De más débil a más fuerte:
Dispersión de London< Dipolo-Dipolo < Puente de Hidrógeno
Ejemplos
|
Sustancia |
Tipo de molécula |
Fuerza predominante |
Estado a temperatura ambiente |
|
O2 |
No polar |
Dispersión |
Gas |
|
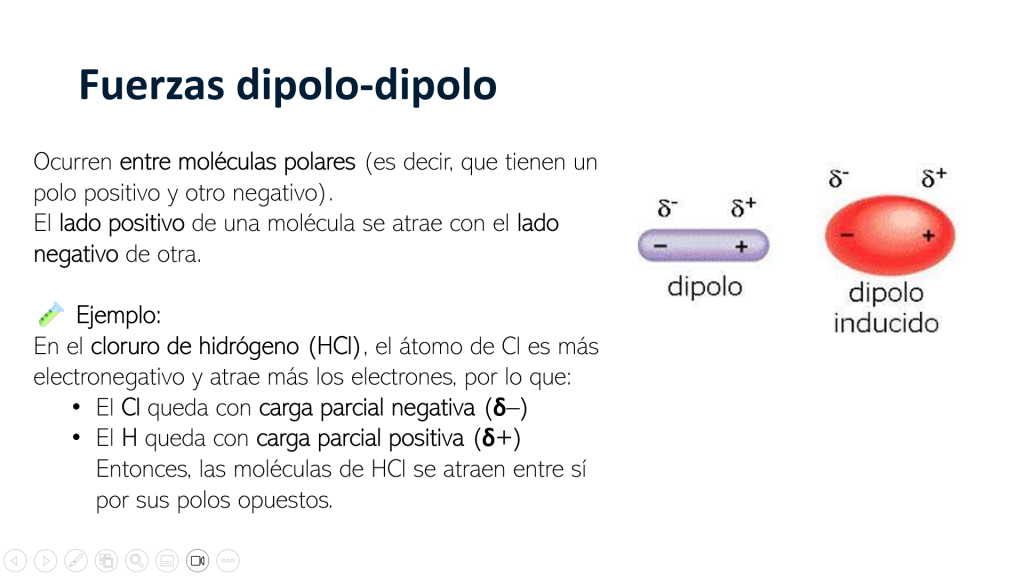
HCl |
Polar |
Dipolo-Dipolo |
Gas |
|
H2O |
Polar con H–O |
Puente de Hidrógeno |
Líquido |
|
NaCl (aq) |
Iónica + polar |
Ion-Dipolo |
Disuelto (solución acuosa) |

