Modelos atómicos, estructura del átomo, propiedades de la tabla periódica y configuración electrónica
¿Qué es un átomo?
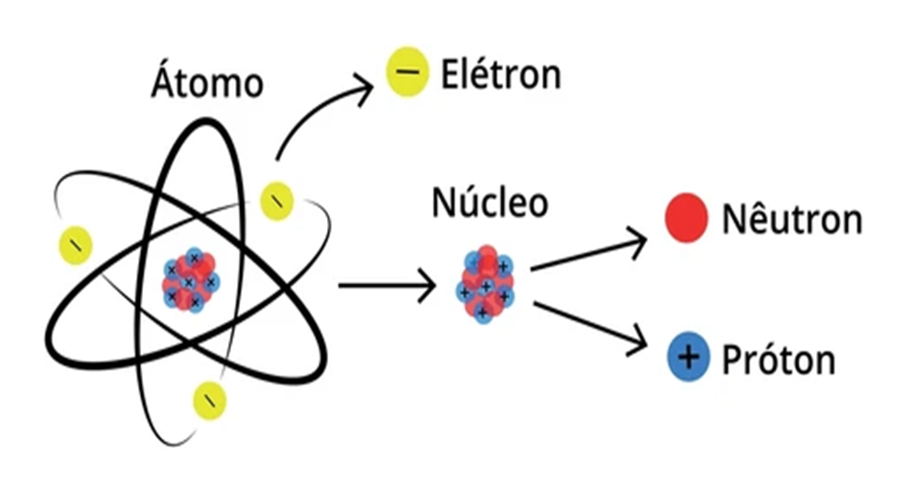
Un átomo es la unidad básica de la materia que conserva las propiedades químicas de un elemento. Está formado por partículas subatómicas: protones, neutrones y electrones. La forma en que se organizan estas partículas explica las propiedades químicas y físicas de los elementos.
Desarrollo histórico: modelos atómicos (línea de tiempo y por qué cambiaron)
Modelo de Dalton (principios del siglo XIX)
John Dalton propuso que la materia está formada por pequeñas partículas indivisibles llamadas átomos.
Cada elemento está formado por átomos iguales entre sí y diferentes a los de otros elementos.
Explicó las leyes de las proporciones definidas y múltiples.
-
Limitación: no explicaba cargas eléctricas, ni la existencia de partículas subatómicas.
Modelo de Thomson (1897) — “modelo del pudín de pasas”
J. J. Thomson descubrió el electrón mediante experimentos con tubos de rayos catódicos.
Propuso que el átomo era una esfera positiva con electrones incrustados (como pasas en un pudín) para explicar la neutralidad.
Aporta: existencia de partículas subatómicas negativas.
-
Limitación: no explicaba cómo estaban distribuidas las cargas y los resultados de futuras dispersión de partículas.
Experimento clave (para Thomson)
-
Tubos de rayos catódicos: los rayos se desviaban por campos eléctricos/magnéticos → existencia de partículas con carga negativa.
Modelo de Rutherford (1911) — “modelo nuclear”
Ernest Rutherford realizó el experimento de la lámina de oro: disparó partículas alfa (He²⁺) contra una lámina delgada de oro.
Observaciones:
-
-
La mayoría de las partículas atravesaron la lámina sin desviarse.
-
Algunas se desviaron mucho y unas pocas rebotaron casi en sentido contrario.
-
Conclusión: el átomo tiene un pequeño núcleo denso y positivo que concentra casi toda la masa, y los electrones ocupan el espacio alrededor.
Aporta: existencia de núcleo con carga positiva (más tarde identificado como protones y neutrones).
-
Limitación: no explicaba la estabilidad de los electrones moviéndose alrededor del núcleo (según la física clásica, un electrón acelerado debió radiar energía y colapsar).
Modelo de Bohr (1913)
Niels Bohr introdujo niveles de energía cuantizados para explicar los espectros atómicos del hidrógeno.
Postulados principales:
-
-
Los electrones se mueven en órbitas circulares alrededor del núcleo con energías discretas (niveles cuantizados).
-
Un electrón no emite energía mientras está en una órbita permitida.
-
Emite o absorbe un fotón cuando salta entre niveles:
-
ΔE=hν\Delta
-
E = h\nu.
-
Explicó correctamente las líneas espectrales del hidrógeno y la fórmula de Rydberg.
-
Limitación: no funciona bien para átomos con más de un electrón y contradice la física ondulatoria de la materia.
Modelo mecánico-cuántico (actual)
Con contribuciones de De Broglie, Heisenberg y Schrödinger, el átomo se describe mediante mecánica cuántica.
Los electrones no siguen órbitas definidas sino funciones de onda (orbitales) que describen probabilidades de encontrar un electrón en un punto del espacio.
La ecuación de Schrödinger (dependiente del sistema) determina las funciones de onda y niveles de energía.
Surge la noción de orbitales atómicos (s, p, d, f), números cuánticos y reglas como el principio de exclusión de Pauli, regla de Hund y principio de Aufbau.
Estructura interna del átomo (partículas subatómicas)
Núcleo
Contiene protones (carga +e) y neutrones (sin carga eléctrica).
Es extremadamente pequeño respecto al átomo, pero concentra la casi totalidad de la masa.
El número de protones define el número atómico Z (identidad del elemento).
El número de nucleones (protones + neutrones) es el número másico A.
Protones
Partícula con carga positiva.
Determinan la carga nuclear y el elemento químico.
Neutrones
Partícula neutra.
Contribuyen a la masa y estabilidad del núcleo (evitan la repulsión entre protones mediante fuerzas nucleares).
Electrones
Partículas con carga negativa (carga -e).
Tienen masa mucho menor que protones/neutrones.
Orbitan o existen en regiones de probabilidad alrededor del núcleo (según el modelo cuántico).
Fuente: http://www.genomasur.com/lecturas/guia02-nueva.htm
Conceptos importantes: isótopos, iones y masa atómica
Isótopos
Átomos del mismo elemento (mismo Z) pero distinto número de neutrones (distinto A).
-
Ejemplos: carbono-12 (¹²C), carbono-13 (¹³C), carbono-14 (¹⁴C).
Propiedades químicas similares; propiedades físicas/nucleares (p. ej. radiactividad) pueden diferir.
Iones
Átomos o grupos de átomos con carga neta debido a pérdida o ganancia de electrones.
Catión = carga positiva (p. ej. Na⁺), anión = carga negativa (p. ej. Cl⁻).
Masa atómica relativa y masa molar
-
La masa atómica (tabla periódica) es un promedio ponderado de las masas de los isótopos según su abundancia natural.
-
La masa molar expresa la masa en gramos por mol (g·mol⁻¹).
Propiedades de la tabla periódica
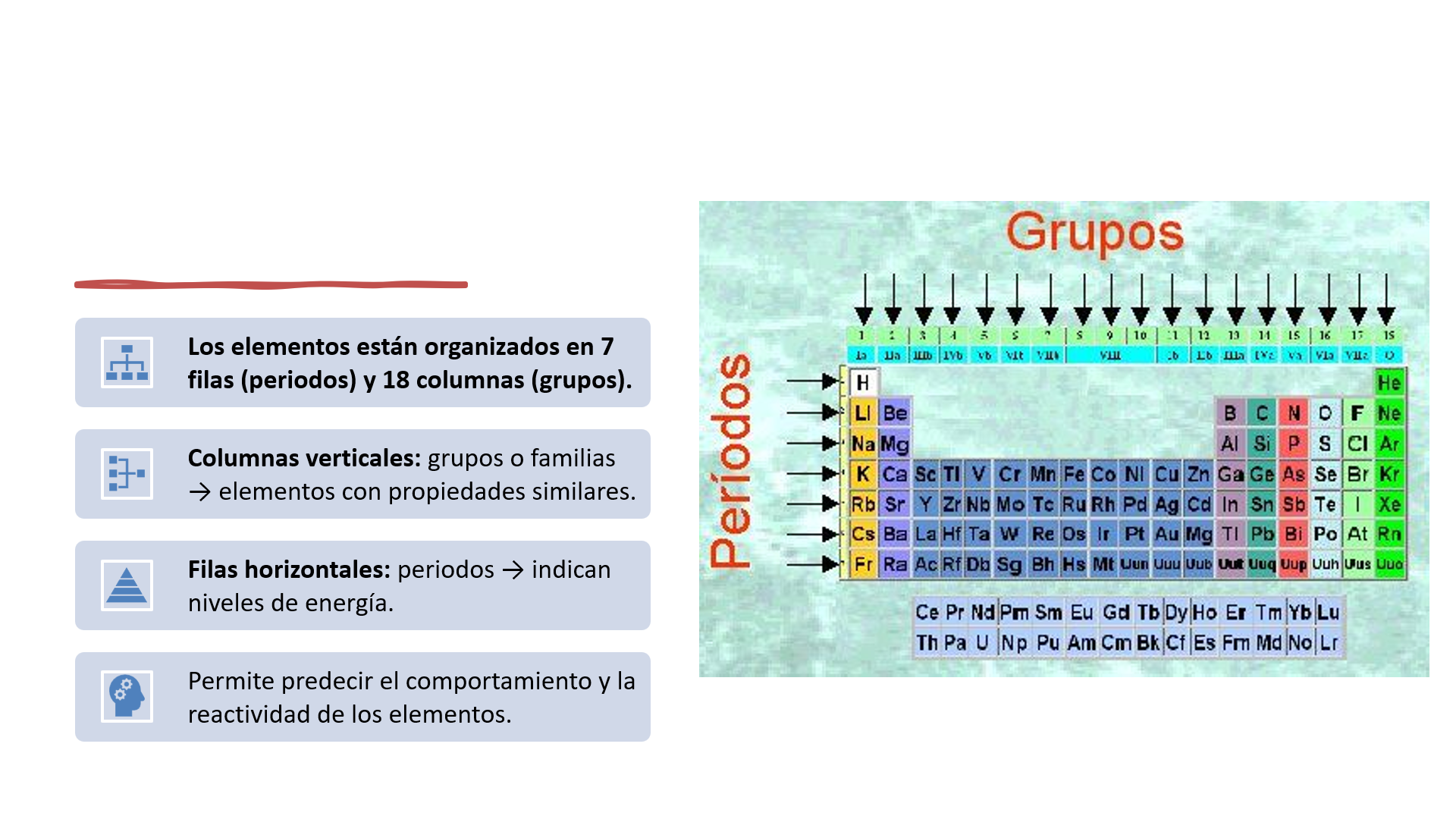
La tabla periódica de los elementos
La tabla periódica es una herramienta organizada que clasifica todos los elementos químicos conocidos según sus propiedades químicas y físicas
Fue diseñada originalmente por Dmitri Mendeléyev en 1869 y ha sido ampliada hasta incluir los elementos actuales.
Organización principal
Su organización principal es la siguiente:
Propiedades periódicas
Las propiedades de los elementos varían de manera predecible a lo largo de la tabla debido a la distribución electrónica y la carga nuclear efectiva.
Radio atómico
Distancia aproximada entre el núcleo y la capa de electrones más externa.
Tendencia en la tabla:
-
-
Aumenta hacia abajo en un grupo → más niveles de energía.
-
Disminuye hacia la derecha en un período → mayor carga nuclear atrae electrones.
-
Ejemplo: el radio de Li > Na > K.
Energía de ionización
Es la energía necesaria para quitar un electrón de un átomo neutro en estado gaseoso.
Tendencia:
-
-
Aumenta hacia arriba y a la derecha.
-
Elementos de la derecha (como F, Ne) requieren más energía para perder electrones.
-
Ejemplo: F > O > N en un mismo período.
Afinidad electrónica
Energía liberada cuando un átomo gana un electrón.
Mayor afinidad → mayor tendencia a formar aniones.
Tendencia: aumenta hacia arriba y a la derecha (excepto gases nobles, que no ganan electrones).
Electronegatividad
Tendencia de un átomo a atraer electrones en un enlace químico.
Tendencia:
-
-
Aumenta hacia arriba y a la derecha.
-
Fluor es el elemento más electronegativo.
-
Carácter metálico y no metálico
-
Metales: conductores, maleables, brillantes. Se encuentran a la izquierda y centro de la tabla.
-
No metales: aislantes, frágiles, sin brillo. Se encuentran a la derecha.
-
Metaloides: propiedades intermedias, se encuentran en la “escalera” que separa metales de no metales.
Configuración electrónica de los elementos
La configuración electrónica describe cómo están distribuidos los electrones de un átomo en los diferentes niveles y subniveles de energía que rodean al núcleo.
Niveles y subniveles:
Los electrones se ubican en niveles de energía (n=1, 2, 3…) y subniveles (s, p, d, f), cada uno con una capacidad específica para contener electrones.
Determinación de la configuración Electrónica
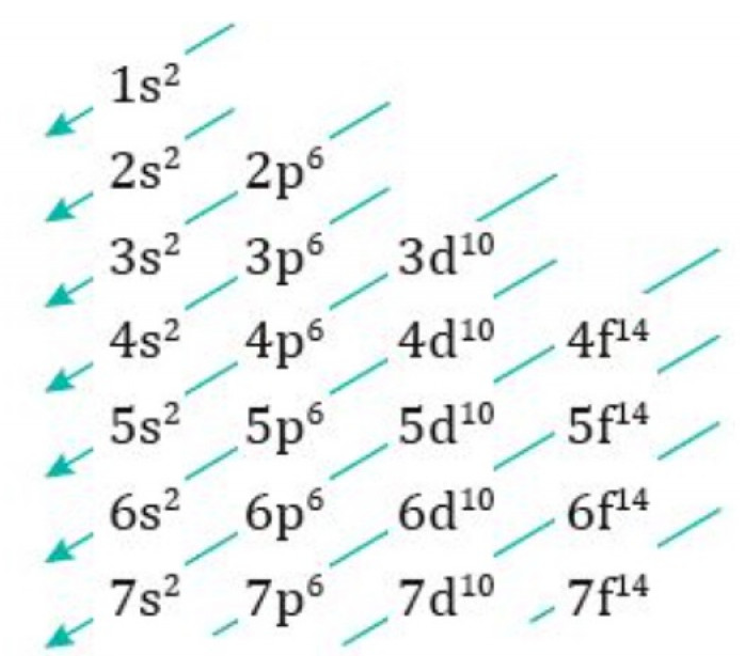
Principio de Aufbau: se llenan desde los orbitales de menor a mayor energía (Regla de las diagonales o diagrama de Moeller).
El diagrama de Moeller o diagrama de Aufbau muestra el orden de llenado de los orbitales según su energía creciente. Las flechas nos indican la secuencia y nos dice qué orbital se llena primero, segundo, etc.
Pasos para determinar la configuración electrónica
Conoce los orbitales y su capacidad
Los subniveles y su capacidad máxima de electrones son:
-
s → 2 electrones
-
p → 6 electrones
-
d → 10 electrones
-
f → 14 electrones
Cada subnivel pertenece a un nivel de energía principal (n = 1, 2, 3…).
Consulta el diagrama de Moeller
El diagrama de Moeller se organiza con diagonales que indican el orden de llenado:
-
Se leen las diagonales de arriba hacia abajo y hacia la derecha.
-
Siguiendo esta regla, los electrones ocupan primero los orbitales de menor energía.
Determina el número de electrones
-
Cada elemento tiene un número atómico (Z) que indica el número de electrones en estado neutro.
-
Ejemplo: Oxígeno → Z = 8 → 8 electrones.
Llena los orbitales siguiendo el diagrama
-
Coloca los electrones uno a uno respetando la capacidad de cada subnivel (s=2, p=6, d=10, f=14).
-
Siguiendo el diagrama, llenamos de menor a mayor energía.
Ejemplo 1: Oxígeno (Z = 8)
-
Primer electrón → 1s → 1s¹
-
Segundo electrón → 1s²
-
Tercer electrón → 2s → 2s¹
-
Cuarto → 2s²
-
Quinto → 2p → 2p¹
-
Sexto → 2p²
-
Séptimo → 2p³
-
Octavo → 2p⁴
Configuración electrónica: 1s² 2s² 2p⁴
Ejemplo 2: Sodio (Z = 11)
-
1s² → 2 electrones
-
2s² → 2 electrones
-
2p⁶ → 6 electrones
-
3s¹ → 1 electrón
Configuración electrónica: 1s² 2s² 2p⁶ 3s¹
Verifica la cantidad de electrones
-
Suma los electrones en la configuración.
-
Debe ser igual al número atómico Z del elemento
Realiza a actividad adjunta en el documento PDF